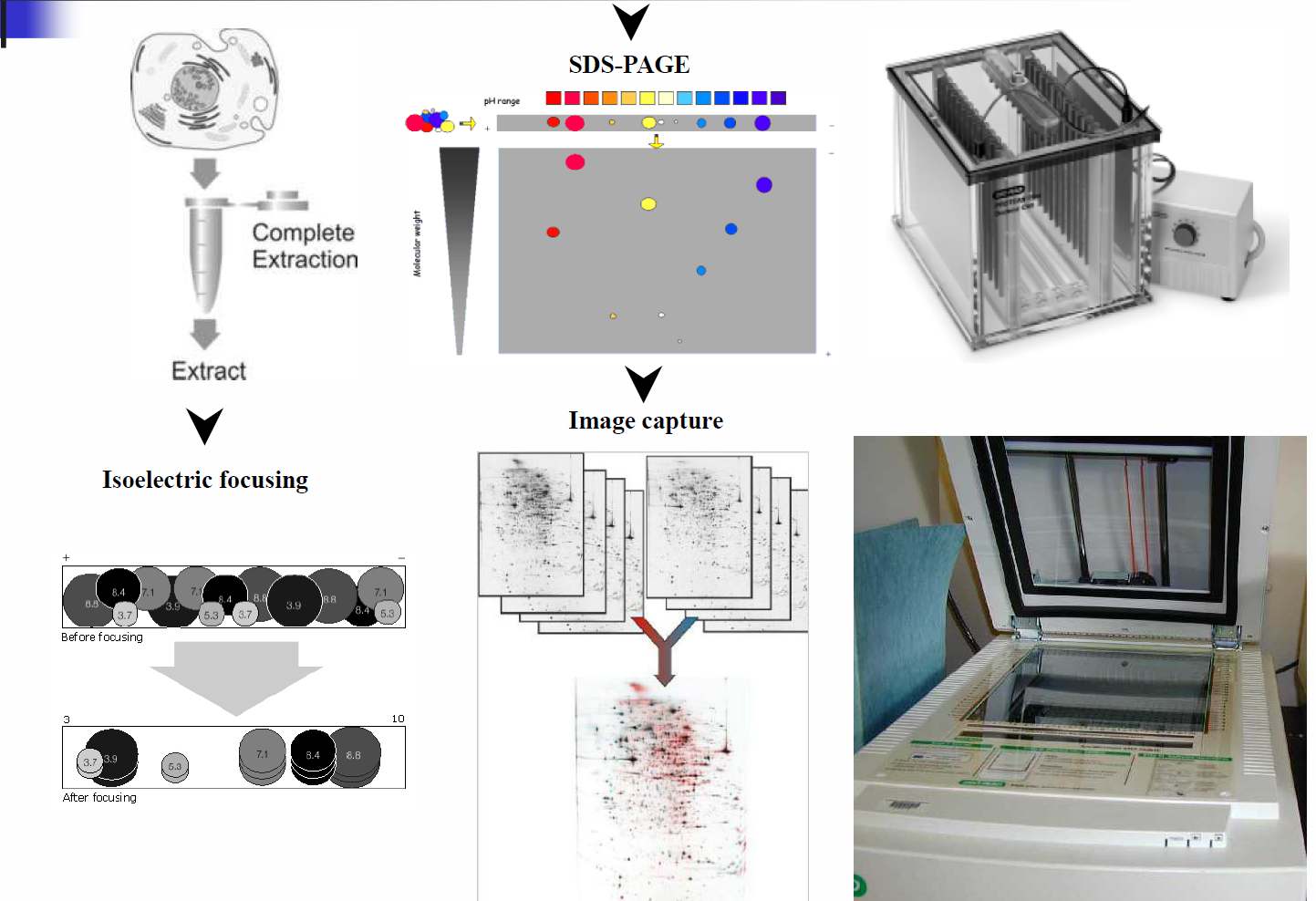
الکتروفورز دوبعدی
الکتروفورز دو بعدی

سلام امروز با خودم گفتم بهتره به جای اخبار برم سراغ یه سری مباحث دیگه ... مثلا اینبار الکتروفورز 2 بعدی خوب حالا الکتروفورز چی هست؟ الکتروفورز ژل پلی اکریل آمید روش استاندارد جداسازی پروتئین ها از مخلوط آن می باشد. در این روش نمونه هايي که بار الکتريکي دارند، تحت تأثير يك ميدان الكتريكي از ميان شبکه اي متخلخل حركت مي کنند. سرعت حرکت مولکولها تحت تاثير:بار الکتریکی ،اندازه و شکل ملکول است. معمولا" الکتروفورز براي جداسازي مولکولهاي بزرگي چون:پروتئین ها و اسیدهای نوکلئیک به کار می رود. اما در مواردي براي جداسازي مولکولهاي باردار کوچکتري نظير: قندها،اسیدهای آمینه ،پپتیدها،یون های ساده براي الکتروفورز يک مخلوط مولکولي, لايه نازکي از آن, بر روي شبکه اي متخلخل که محلولي را درون خود محبوس کرده است, قرار داده مي شود. پس از برقراي ميدان الکتريکي با اِعمال اختلاف پتانسيل در دو سوي اين شبکه, مولکولهاي موجود در نمونه با سرعت هاي متفاوتي درون شبکه متخلخل شروع به حرکت مي کنند. اين اختلاف سرعت مبناي جداسازي در الکتروفورز است در پايان, مولکولهاي پروتئيني مختلف به صورت باند هايي مجزا در قسمت هاي مختلف شبکه آشکار مي شوند. الکتروفورز ژل پلی اکریل آمید روش استاندارد جداسازی پروتئین ها از مخلوط آن می باشد. است.مرسوم ترین روش برای جداسازی استفاده از دترجنت SDSمی باشد. روش دیگرجداسازی پروتئین ها در ژل یا ایزوالکتریک فوکوسینگ است. در پروفایل نمودن پروتئین ها این دو روش ترکیب شده و الکتروفورز دوبعدی نامیده می شود. طی الکتروفورز دو بعدی توسط میدان الکتریکی ابتدا پرتئین ها در محورxبر اساس تمرکز ایزوالکتریک و سپس در محور yبر اساس تفاوت در جرم ملکولی جدا میشوند. خوب تا اینجا کلیات الکتروفورز گفته شد ... خدارو شکر توضیح ۲ بعد جداسازی میمونه برای بعد.. فعلا (دوستای گلم اگه این مطلب براتون مفید بود خواهشا حتما تو نظرات اعلام کنید و اگرهم جایی کم و کاستی هست بازم خواهش میکنم که کامنت بذارید تا منم یاد بگیرم.) "استفاده از این مطلب با ذکر منبع بلامانع است"
پزوتئومیکس
کاربرد های اصلی پروتئومیک 1- تعیین پروفایل پروتئوم (شامل پژوهش های مرتبط با جداسازی و شناسایی پروتئین ها، اندازه گیری میزان پروتئین و ..) 2- پروتئومیک مقایسه ای (مطالعه تفاوت بیان پروتئین ها در گونه های متفاوت، تیمار های متفاوت و ...) 3- پروتئومیک بر هم کنش ها یا اینتراکتومیک (مطالعه برهم کنش های پروتئین-پروتئین) 4- مطالعه اصلاحات پس از ترجمه پروتئین ها و ... ابزارهای اصلی پروتئومیک پروتئومیک امکان مطالعه همزمان هزاران پروتئین را فراهم نموده است. مطالعات پروتئومیک بر اساس ابزار مورد استفاده به دو دسته کلی قابل تقسیم هستند: 1- مطالعات بر مبنای ژل (Gel Based) 2- مطالعات بر اساس طیف سنجی جرمی (Mass Based) الکتروفورز دو بعدی ابزار بنیادی پروتئومیک محسوب می شود. در این تکنیک کل پروتئین های استخراج شده از یک بافت، سلول و ... به طور همزمان با حساسیت و قدرت تفکیک بالا مورد آنالیز و شناسایی قرار می گیرند. در سال 1975 پاتریک افارل سیستم IEF (Iso Electric Focusing) را برای بعد اول معرفی نمود و در سال 1988 آنجلیکا گرگ پروتکل اصلی الکتروفورز دوبعدی بر مبنای استفاده از شیب تثبیت شده PH بر روی نوار های IPG (Immobilized pH Gradient) در بعد اول را تعریف کرد. در تکنیک الکتروفورز دوبعدی، پروتئین ها در بعد اول با انجام IEF بر روی نوار های ژل IPG بر مبنای بار الکتریکی ذاتی خود از هم جدا می شوند و سپس نوار ها بر روی ژل SDS، پروتئین ها بر مبنای وزن مولکولی از هم تفکیک می گردند. رنگ آمیزی ژل های حاصل از الکتروفورز دو بعدی با تکنیک های متفاوت رنگ آمیزی ژل با توجه به ویژگی ها و حساسیت های روش های متفاوت صورت می گیرد. پس از رنگ آمیزی، وجود هر لکه بر روی ژل بیانگر وجود یک یا چند پروتئین با pH و شکل 1- الکتروفورز دو بعدی وزن مولکولی مشخص می باشد. تجزیه و تحلیل کمی نقاط با استفاده از نرم افزار های تجزیه و تحلیل عکس مانند Melanie 4 صورت می گیرد و نهایتاً آزمون مقایسه میانگین ها با استفاده از روش های متداول آماری صورت می گیرد. پروتئین هایی که مورد علاقه محقق قرار می گیرند می بایست شناسایی و تأیید شوند تا بتوان در مورد نقش آنها در بروز صفات یا تفاوت ها اظهار نظر کرد. لذه پروتئین ها از روی ژل بریده شده و با استفاده از دستگاه طیف سنجی جرمی توالی اسید آمینه پروتئین مشخص می شود اما جهت تأیید این نتایج استفاده از تکنیک وسترن بلات مرسوم می باشد. این تکنیک پروتئین ها را بر اساس واکنش با آنتی بادی مخصوص خود شناسایی می کند. واکنش بین آنتی بادی-آنتی ژن از اختصاصیترین پیوند های شناخته شده طبیعت می باشد.کاربرد اطلاعات حاصل از پروتئومیک می تواند ...
الکتروفورز دو بعدی چیست
الکتروفورز روشی است که در آن نمونههایی که بار الکتریکی دارند، تحت تأثیر یک میدان الکتریکی از میان شبکه ایمتخلخل حرکت می کنند و از یکدیگر جدا می شوند. سیر تکوین وتکامل این روشدر جداسازی پروتئینها ارتباط تنگاتنگی با تلاشهای انجام شده در بررسیپروتئینهای سرم دارد. در سال1937، "Tiselius" روشی برای جداسازی الکتروفورتیک پروتئینهای سرمابداع کرد. انگیزه اصلی برای طراحی این روش، که بعدها به الکتروفورز منطقهای " Zone Electrophoresis" مشهور شد، مشکلاتی بود که درحین بررسیپروتئینهای سرم وجود داشت. "Tiselius" برای اولین بار فراکشن های آلفا ،بتا، و گاما را در سرم تشریح و نام گزاری کرد. وی به خاطر تحقیق بر رویالکتروفورز و آنالیز جذبی، بخصوص اکتشافاتی که ماهیت پیچیده ی پروتئینهایسرم را مشخص می کرد، جایزه ی نوبل شیمی را در سال 1948 از آن خود کرد.نقطه ی عطف در توسعة الکتروفورز در دهه های 40 و 50 زمانی روی داد کهعلاوه بر الکتروفورز منطقه ای دو روش دیگر نیز ظهور کردند: ایزوالکتروفوکوسینگ ", IEFIsoelectrofocusing" و ایزوتاکوفورزیز " Isotachophoresis". بنابراین در آن زمان امکان انجام آنالیزهای جداسازیالکتروفورتیک سه گانه بر روی مخلوطهای پروتئینی یا بصورت جدا یا در ترکیببا همدیگر بوجود آمد. اولین تجارب در جداسازی توسط الکتروفورز دوبعدی به کارهای Smithies و Poulik در سال 1956 باز می گردد که با بکار بردنِ ترکیبی از الکتروفورز برروی کاغذ و بر روی ژل نشاسته پروتئین های سرم را جداو تفکیک کردند.پیشرفتهای بعدی در فناوری الکتروفورز، نظیر استفاده از پلی آکریل آمید واستفاده از شیبهای غلظتی پلی آکریل آمید، به سرعت در جداسازی های دو بعدیبه کار گرفته شد. به خصوص استفاده از"IEF" در جداسازی دو بعدی این امر راامکان پذیر ساخت که جداسازی بُعد اول بر پایه خصوصیات بار الکتریکی پروتینها صورت پذیرد. در سال 1970 الکتروفورز ژل پلی آکریل آمید به همراه سدیمدو دسیل سولفات " Sodium Dodecylsulfate-Polyacrylamide Gel Electrophoresis, SDS-PAGE" توسط "Laemmli" معرفی شد. ترکیب "IEF" با "SDS-PAGE" در بُعد دوم منجر به ابداع روشی گشت که پروتئین ها را بر پایهدوعامل متفاوت یعنی بار الکتریکی و جرم مولکولی از یکدیگر جدا می ساخت. این روش برای انواع متفاوتی از نمونه ها با خواص حل پذیری متفاوت انطباقیافت؛ بدین معنی که استفاده از اوره و دترجنت های غیریونی در "IEF"، امکانمحلول سازی نمونه های متفاوت را فراهم نمود. بدین ترتیب تا سال 1975 یکسیستم الکتروفورز دوبعدی تکامل یافت که می توانست برای آنالیز مخلوط هایپروتئینی بدست آمده از کلِ یک سلول یا بافت ها بکار گرفته شود. براساس اینپیشرفتها "O’Farrell" درسال 1975 روش الکتروفورز دوبعدی را که برایجداسازی پروتئینهای "E.coli" ...
پروتئوم و پروتئومیک
مقدمهبا تکمیل پروژه ژنوم انسان مشخص شد که مکانیسم مولکولی رفتار سلولها در شرایط مختلف را نمیتوان از روی توالی ژنهای آنها پیشگویی کرد. رفتار سلولی و تمام فعالیتهایی که در سلول انجام میشود بر عهده پروتئینها است. در واقع برای ارتباط ژنوم با رفتار سلولها باید پروتئینهای سلولها را شناخت. به کلیه پروتئینهایی که در یک سلول در یک زمان مشخص بیان میشود، پروتئوم آن سلول گفته میشود و این پروتئوم است که فاصله بین ژنوم و مکانیسم مولکولی رفتار سلولی را پر میکند.برخلاف ژنوم، برای هر اورگانیسم نمیتوان یک پروتئوم واحد تعریف کرد. پروتئوم سلولهای مختلف با یکدیگر متفاوت اند. یعنی سلولها علاوه بر پروتئینهای ضروری که در همه انواع سلولها بیان میشوند ، دارای یکسری پروتئینهای اختصاصی نیز هستند. از این رو بهتر است پروتئوم را برای هریک از انواع سلولها تعریف نمود. با این حال پروتئوم یک نوع سلول نیز همیشه ثابت نیست. سلول در برابر شرایط مختلف محیطی و پیامهایی که از سلولهای اطراف دریافت میکند، پروتئینهای مختلفی را بیان میکند. بعبارت دیگر هر سلول تحت شرایط مختلف پروتئومهای متفاوتی دارد.بنابر این برای شناسایی مکانیسمهای مولکولی رفتار سلولی و واکنشهای زیستی، لازم است پروتئینهایی که در یک سلول بیان میشود، تغییرات آنها در شرایط مختلف، عملکرد آنها و همچنین برهمکنشهای بین پروتئینهای مختلف در یک سلول، بررسی شود. به مجموعه این بررسیها، نقشه برداری پروتئوم یا پروتئومیک ، گفته میشود.نقشه برداری پروتئـــوممطالعه پروتئوم به سادگی مطالعه ژنوم نیست. زیرا پروتئینها را نمیتوان(همانند DNA) به روشی مشابه PCR، تکثیر کرد. همچنین توالیهای پلیپپتیدی نمیتوانند به توالیهای اسید آمینه ای مکمل خود متصل شوند. بنابر این برای مطالعه پروتئوم باید از ابزار و روشهای ویژه ای استفاده کرد. در پروتئومیک نه تنها کلیه پروتئینهایی که در یک سلول دریک شرایط مشخص بیان میشوند، مورد بررسی قرار میگیرند، بلکه عملکرد و رفتار پروتئینها، برهمکنشهای بین پروتئینهای مختلف، آرایشهایی که پس از ترجمه بر روی پروتئینها ایجاد میشود و نیمه عمر آنها در سلول نیز مورد بررسی قرار میگیرد. در واقع پروتئومیک از سه بخش تشکیل شده است:1- مشخص کردن کلیه پروتئینهایی که در سلول بیان میشود :در این بخش، کلیه پروتئینهایی که در سلول تحت یک شرایط معین (مانند، حالت استراحت، رشد، تمایز، بیماری، تاثیر دارو و...) مشخص میشود. به این ترتیب میتوان پروتئینهایی که در شرایط مختلف بیان میشوند یا میزان بیان آنها تغییر میکند را شناسایی کرد و به عملکرد آنها پی برد. شناسایی این پروتئینها در تشخیص بیماری ...
الکتروفورز دو بعدی چیست ؟
الکتروفورز دو بعدی چیست ؟الكتروفورز روشي است كه در آن نمونه هايي که بار الکتريکي دارند، تحت تأثير يك ميدان الكتريكي از ميان شبکه اي متخلخل حركت مي کنند و از يکديگر جدا مي شوند. سير تکوين وتکامل اين روش در جداسازي پروتئينها ارتباط تنگاتنگي با تلاشهاي انجام شده در بررسي پروتئينهاي سرم دارد.در سال1937، "Tiselius" روشي براي جداسازي الكتروفورتيك پروتئينهاي سرم ابداع کرد. انگيزه اصلي براي طراحي اين روش، كه بعدها به الکتروفورز منطقه اي " Zone Electrophoresis" مشهور شد، مشكلاتي بود كه درحين بررسي پروتئينهاي سرم وجود داشت. "Tiselius" براي اولين بار فراكشن هاي آلفا ، بتا، و گاما را در سرم تشريح و نام گزاري كرد. وي به خاطر تحقيق بر روي الكتروفورز و آناليز جذبي، بخصوص اكتشافاتي كه ماهيت پيچيده ي پروتئينهاي سرم را مشخص مي كرد، جايزه ي نوبل شيمي را در سال 1948 از آن خود کرد.نقطه ي عطف در توسعة الكتروفورز در دهه هاي 40 و 50 زماني روي داد كه علاوه بر الكتروفورز منطقه اي دو روش ديگر نيز ظهور كردند: ايزوالكتروفوكوسينگ ", IEFIsoelectrofocusing" و ايزوتاكوفورزيز " Isotachophoresis". بنابراين در آن زمان امكان انجام آناليزهاي جداسازي الكتروفورتيك سه گانه بر روي مخلوطهاي پروتئيني يا بصورت جدا يا در تركيب با همديگر بوجود آمد. اولين تجارب در جداسازي توسط الکتروفورز دوبعدي به کارهاي Smithies و Poulik در سال 1956 باز مي گردد که با بکار بردنِ ترکيبي از الکتروفورز بر روي کاغذ و بر روي ژل نشاسته پروتئين هاي سرم را جداو تفکيک کردند.پيشرفتهاي بعدي در فناوري الکتروفورز، نظير استفاده از پلي آکريل آميد و استفاده از شيبهاي غلظتي پلي آکريل آميد، به سرعت در جداسازي هاي دو بعدي به کار گرفته شد. به خصوص استفاده از"IEF" در جداسازي دو بعدي اين امر را امکان پذير ساخت که جداسازي بُعد اول بر پايه خصوصيات بار الکتريکي پروتين ها صورت پذيرد. در سال 1970 الكتروفورز ژل پلي آكريل آميد به همراه سديم دو دسيل سولفات " Sodium Dodecylsulfate-Polyacrylamide Gel Electrophoresis, SDS-PAGE" توسط "Laemmli" معرفي شد. ترکيب "IEF" با "SDS-PAGE" در بُعد دوم منجر به ابداع روشي گشت که پروتئين ها را بر پايه دوعامل متفاوت يعني بار الکتريکي و جرم مولکولي از يکديگر جدا مي ساخت. اين روش برای انواع متفاوتي از نمونه ها با خواص حل پذيری متفاوت انطباق يافت؛ بدين معني که استفاده از اوره و دترجنت های غيريونی در "IEF"، امکان محلول سازي نمونه هاي متفاوت را فراهم نمود. بدين ترتيب تا سال 1975 يک سيستم الکتروفورز دوبعدي تکامل يافت که مي توانست برای آناليز مخلوط های پروتئينی بدست آمده از کلِ يک سلول يا بافت ها بکار گرفته شود. براساس اين پيشرفتها "O’Farrell" درسال 1975 روش الکتروفورز ...
پروتئومیکس Proteomics
پروتئومیکس Proteomics واژه پروتئوم (Proteome) به تمام پروتئینهایی اطلاق میشود كه به وسیله موجود زنده تولید میشود. برخلاف ژنوم(Genome) که ماهیتی ثابت و پایدار دارد، پروتئوم ماهیتی دینامیک و متغیر دارد و به عنوان پروتئینهای موجود در یك سلول، بافت و یا اندام ارگانیسم در یك مقطع زمانی مشخص تعریف میشود. ژنوم انسان حدود 22000 ژن را کد میکند این درحالی است که تخمین زده میشود که تعداد پروتئینهایی که از طریق به هم متصل شدن متناوب (Alternative splicing) و یا تغییرات پس از ترجمه (Post-translational modification) بوجود میآیند حداقل 50 برابر این تعداد باشند. مشخص شده كه پروتئینها، پس از ترجمه، در پاسخ به تغییرات سیگنالهای درون سلولی و بیرون سلولی، تغییر مییابند.بیش از 200 نوع از این تغییرات (که نقش زیادی در پیام دهی و عملکرد یک سلول دارند) بر روی پروتئینهای مختلف شناسایی شدهاند که مهمترین آنها شامل فسفوریلاسیون، استیلاسیون، گلیکوزیلاسیون و نیتراسیون میباشند. تاریخچه پروتئومیكس در سال 1975 و با معرفی الکتروفورز دو بعدی-قلب تكنولوژی پروتئوم- به وسیلهFarrell و Klosejبمنظور نقشهیابی پروتئینهای باکتری ای کولای و سپس موش و خوکچه هندی شروع شد، با این همه واژه پروتئومیكس تا سال 1995 معرفی نشده بود. با شروع توالییابی ژنوم انسان در سال 2000، دوره پس از ژنومیک (Post-Genomic) شروع شد كه پروتئومیكس بخش مهمی از آنرا شامل میشود. هدفپروتئومیكس كامل كردن نقشه سه بعدی تمام پروتئینهایی است كه در سلول اثر متقابل دارند كه درسال 2001 در میكروارگانیسمHelicobacter pylori این هدف میسر شد. كاربردهای پروتئومیكس در ژنتیك و اصلاح نباتات - بررسی تنوع ژنتیكی شامل تفاوتهای ژنتیكی درون و بین گونهای، تشخیص واریتهها، لاینها و ارقام - بیان ژنوم؛ مشخص كردن موتانتها، تغییر پذیری بیان پروتئینها براساس اندام و مرحله رشدی گیاه، شناسایی و نشان دادن پروتئینهای حساس به استرسهای غیر زنده - تهیه نقشه ژنتیكی و شناسایی پروتئینهای معرف نقش اطلاعات ژنومی در پروتئومیکس رشد پروتئومیكس، نتیجه پیشرفت توالییابی نوكلئوتیدی توالیهای هدف بیان شده و DNA ژنومی در مقیاس گسترده میباشد. بدون این اطلاعات، حتی با وجود پیشرفتهاییكه در زمینه MSصورت گرفته است، امکان شناسایی پروتئینها فراهم نمیشد. مقایسه پروتئومیكس و ژنومیكس برخلاف ژنومیكس (Genomics) كه شكل ثابتی از ژنوم در یك ارگانیسم وجود دارد، در پروتئومیکس تعداد زیادی پروتئوم در یك ارگانیسم وجود دارند. بنابراین پروتئومیكس زمینه بسیار گستردهتری نسبت به ژنومیكس دارد و پیچیده بودن پروتئوم با این گفته نشان ...
two-dimensional elechtrophoresis

سلام نوبتیم که باشه نوبت ۲تا بعد الکتروفورز دو بعدیه... همون طور که قبلا اشاره کردیم طی الکتروفورز 2 بعدی پروتئین ها بر اساس نقطه ایزوالکتریک و در مرحله بعد براساس جرم ملکولی شان از هم تفکیک میشوند. ابتدا باید3 موضوع رو تعریف کنیم: 1-نقطه ایزوالکتریک: PHاست که در آن بار خالص پروتئین برابر با صفر است. 2-آمفولیت: الکترولیت آمفوتر هستند. 3-آمفوتر:به اسیدهای آمینه با وزن ملکولی پایین گفته میشود که درمحلولهای آبی خاصیت دو قطبی نشان می دهند. بعد اول: ایزوالکتریک فوکوسینگ این روش برای تعیین نقطه ایزوالکتریک یک پروتئین نیز بکار می رود. با اختلاط بازها واسیدهای آلی دارای وزن ملکولی پایین و انتشار آن ها در میدان الکتریک ایجاد شده در عرض ژل ،یک شیب PHبوجود می آید .وقتی مخلوط پروتئین در این شیب قرار داده می شود هر پروتئین برای رسیدن به PHبرابر PIبا خود در داخل ژل حرکت می نماید به این ترتیب پروتئین های دارای نقاط ایزوالکتریک مختلف بطور متفاوت درداخل ژل انتشار می یابد. این روش برای تعیین نقطه ایزوالکتریک یک پروتئین نیز بکار می رود. بعد دوم:SDS-PAGE ژل به دست آمده از مرحله اول 90 درجه چرخانده میشود و روی صفحه SDS-PAGEقرار می گیرد. در این بعد از دترجنتSDS استفاده میشود. SDSبه اکثر پروتئین ها به میزانی اتصال می یابد که تقریبا متناسب با وزن ملکولی پروتئین است این میزان در حدود 1 SDSملکول برای هر دو ریشه اسید آمینه است .SDSاتصال یافته بار خالص منفی زیادی در پروتئین ایجاد می کند و با خنثی نمودن بار ابتدایی پروتئین ،به هر پروتئین نسبت مشابه بار به جرم می دهد از اینرو SDSسبب جداسازی پروتئین ها تنها بر اساس جرم آنها میشود.بطوریکه پپتید های کوچکتر حرکت سریع تر را پیدا میکنندو در پایین ژل قرار می گیرند. بعد از الکتروفورز با افزودن یک رنگ که معمولا پروتئین اتصال یافته و به خود ژل اتصال نمی گردد پروتئین ها رویت می شوند.به هاین ترتیب میتوان پیشرفت یک تخلیص پروتئین را در نظر گرفت. خوب اینم از پرونده الکتروفورز دوبعدی با آرزوی موفقیت برای همه منبع:lehninger principles of biochemistry (دوستای گلم اگه این مطلب براتون مفید بود خواهشا حتما تو نظرات اعلام کنید و اگرهم جایی کم و کاستی هست بازم خواهش میکنم که کامنت بذارید تا منم یاد بگیرم.) "استفاده از این مطلب با ذکر منبع بلامانع است"
شاخه بندی شیمی تجزیه
شاخه بندی شیمی تجزیه ۱-جداسازی Separation … 2-الکتروشیمی electrochemistry … 3-اسپکتروسکوپی spectroscopy… 4-کمومتریکس chemometrics … ………………………………………………………………. 1-1- کروماتوگرافیchromatography… 2-1- استخراجextraction 3-1- فیلتراسیونfiltration 4-1- دیالیزdialysis… …………………………………………………………………. 1-1-1- کروماتوگرافی گازیGas chromatography 2-1-1- کروماتوگرافی سیال فوق بحرانیSuper critical chromatography 3-1-1- کروماتوگرافی مایعLiquid chromatography… 4-1-1- الکتروفورزElectrophoresis… ………………………………………………………………………. 1-3-1-1- (Reversed-phase chromatography (RPCکروماتوگرافی فاز معکوس ۲-۳-۱-۱- ( Normal-phase chromatograph(NPC کرماتوگرافی فاز نرمال ۳-۳-۱-۱- (Non-aqueous reversed-phase chromatography (NARPکرماتوگرافی فاز معکوس غیر آبی ۴-۳-۱-۱- (Hydrophilic interaction Chromatography (HILIC)کروماتوگرافی برهمکنشهای آبدوستی ۴-۳-۱-۱- (Ion-exchange chromatography (IECکروماتوگرافی تعویض یون ۵-۳-۱-۱- (Ion-pair chromatography (IPCکروماتوگرافی جفت یون ۶-۳-۱-۱- (Size-exclusion chromatography (SECکروماتوگرافی اندازه طردی ………………………………………………………………………… ۱-۴-۱-۱- Routine electrophoresis الکتروفورز معمولی ۲-۴-۱-۱- (High resolution electrophoresis (HRE الکتروفورز قدرت تفکیک بالا ۳-۴-۱-۱- Gel electrophoresis ژل الکتروفورز ۴-۴-۱-۱- Isoelectric focusing تمرکز ایزوالکتریک ۵-۴-۱-۱- Capillary electrophoresis الکتروفورز مویینه ۶-۴-۱-۱- Two dimensional electrophoresis الکتروفورز دوبعدی ۷-۴-۱-۱- Immunofixation electrophoresis الکتروفورز تحکیم ایمنی ۸-۴-۱-۱- Electroimmunoassay electrophoresis الکتروفورزالکترو سنجش ایمنی ۹-۴-۱-۱- Pulsed field electrophoresis الکتروفورز زمینه پالسی …………………………………………………………………………… ۱-۴-۱- Hemodialysisهمودیالیز ۲-۴-۱- Peritoneal dialysis پریتونیل(صفاقی)دیالیز ۳-۴-۱- Hemofiltrationهموفیلتراسیون ۴-۴-۱- Electrodialysisالکترودیالیز ۵-۴-۱- Hemodiafiltrationهمودیافیلتراسیون ۶-۴-۱- Intestinal dialysisدیالیز اینتستینال(روده ای) ………………………………………………………………. ۱-۲- Polarography…پلاروگرافی ۲-۲- Voltammetry and Related New Techniques…ولتامتری و تکنیک های مرتبط ۳-۲- Electrogravimetry and Coulometryالکتروگراویمتری و کولومتری ۱-۲- Potentiometry پتانسیومتری ۴-۲- Conductimetryهدایت سنجی ۵-۲- Electrochemical Instrumentation – Roles of Operational Amplifiers and Microcomputers دستگاهوری الکتروشیمایی و کاربرد تقویت کننده ها و میکروکامپیوترها ………………………………………………………………………… ۱-۱-۲- DC Polarography پلاروگرافی جریان مستقیم ۲-۱-۲- AC Polarographyپلاروگرافی ...
