فرایند تولید متانول
متانول
متانول یا متیل الکل یا الکل متیلیک یا الکل چوب که سادهترین نوع الکل هاست با فرمول شیمیایی CH۳OH شناخته میشود. متانول از فعالیت بی هوازی گونههای زیادی از باکتری ها تولید میشود و در نتیجه مقدار اندکی از بخار متانول وارد جو میشود و پس از چندین روز بهوسیله اکسیژن و با کمک نور خورشید اکسید شده به آب و دی اکسید کربن تبدیل میگردد. البته در فرآیند سوختن متانول هم از نظر مواد بدست آمده چنین اتفاقی رخ میدهد ولی بسیار سریعتر. در ضمن شعله سوختن متانول بیرنگ است و باید مراقب باشیم تا با شعله آن دچار سوختگی نشویم. ۲CH۳OH + ۳ O۲ → ۲ CO۲ + ۴ H۲Oدر سال ۱۹۲۳ شیمیدان آلمانی ، "ماتیاس" پیر، متانول را از گاز سنتز (مخلوطی از CO و H۲ که از کک بدست میآید) تولید کرد. در این فرآیند، از کرومات روی به عنوان کاتالیزور استفاده میشد و واکنش در شرایط سختی مانند فشار ۱۰۰۰-۳۰۰ اتمسفر و دمای حدود ۴۰۰ درجه سانتیگراد انجام میگرفت. در شیوه مدرن تولید متانول، از کاتالیزورهایی استفاده میشود که در فشارهای پائین عمل میکنند و کارایی موثرتری دارند. امروزه گاز سنتز مورد نظر برای تولید متانول مانند گذشته از زغال بدست نمیآید، بلکه از واکنش متان موجود در گازهای طبیعی تحت فشار ملایم ۱۰-۲۰ اتمسفر و دمای ۸۵۰ درجه سانتیگراد با بخار آب و در مجاورت کاتالیزور نیکل تولید میشود. CO و H۲ تولید شده، تحت تاثیر کاتالیزوری که مخلوطی از مس و اکسید روی و آلومینیوم است، واکنش داده و متانول ایجاد میکنند. این کاتالیزور اولین بار درسال ۱۹۶۶ توسط ICI استفاده شد. این واکنش در فشار ۵۰-۱۰۰ اتمسفر و دمای ۲۵۰ درجه سانتیگراد صورت میگیرد. روش دیگر تولید متانول، واکنش دیاکسیدکربن با هیدروژن اضافی است که تولید متانول و آب میکند. کاربرد : بهعنوان ضد یخ و حلال و سوخت بکار برده میشود.از متانول برای تقلیب اتانول نیز استفاده میشود، این عمل به منظور غیر قابل شرب نمودن(در کشورهای اسلامی به جهت مسائل شرعی و در کشورهای دیگر به جهت معافیت از مالیات فروش مواد مستکننده) اتانولی که به منظور مصارف صنعتی تولید میشود انجام میپذیرد. بدین منظور از مواد دیگری چون پیریدین و تریانتین نیز استفاده میشود. متانول به صورت محدود به عنوان سوخت در موتورهایی با سیستم احتراق داخلی استفاده میشود. متانول تولید شده از چوب و سایر ترکیبات آلی را متانول آلی یا بیو الکل مینامند که یک منبع تجدید شدنی برای سوخت است و میتواند جایگزین مشتقات نفت خام شود. با این همه، از بیو الکل ۱۰۰ درصد نمیتوان در ماشینهای دیزلی بدون ایجاد تغییر در موتور ماشین استفاده کرد. ...
تولید SCP از متانول، راه حل بیوتكنولوژی برای معضل كمبود خوراك دام و طیور
تولید SCP از متانول، راه حل بیوتكنولوژی برای معضل كمبود خوراك دام و طیور مشكل كمبود آب در سطح جهان و به تبع آن خشكسالی و از بین رفتن منابع طبیعی، باعث شده است كه كمبود علوفه و غذای دام، به یكی از مهمترین دغدغههای صنعت دامپروری بدل شود. بیوتكنولوژی میتواند با تولید پروتئینهای افزودنی نظیر SCP، ضایعات غنی شده، اسیدهای آمینه و آنزیمهای كمكهضمكننده و همچنین با طراحی و تهیه علوفههای بهتر با استفاده از تغییر ژنتیكی گیاهان و تعادل اسیدهای آمینه، نیازهای تغذیهای دام و كمبودهای آن را برآورده سازد. متن زیر مروری كوتاه بر برخی روشهای تولید پروتئین تكنولوژی یاخته (SCP) دارد كه یكی از دستاوردهای بیوتكنولوژی در زمینة غذای دام و طیور است: تاریخچه تولید SCP از هیدروكربنهای نفتی تولید SCP از متان تولید پروتئین تك یاخته (SCP) از متانول تاریخچهپروتئین تكیاخته (SCP) اصطلاحی پذیرفته شده برای توده سلولی میكروبی است كه به عنوان غذای انسان و خوراك دام به كار میرود. این اصطلاح برای اولین بار در سال 1986 توسط پروفسور كارول ویلسون در انستیتو تكنولوژی ماساچوست (MIT)، به كار برده شد. این اصطلاح برای مادة با محتوای پروتئینی كمتر از 65 درصد مناسب نیست و كمیتة تخمیر واحد بینالمللی شیمی محض و كاربردی، اصطلاح "تودة سلولی تكیاخته" را برای چنین مواردی توصیه میكند. همچنین مناسبتر است، برای تودة سلولی محتوی پروتئین به دست آمده از قارچ، اصطلاح "پروتئین قارچی" كه اخیراً در بسیاری از منابع بكارگرفته شده است، استفاده شود. اولین كنفرانس بینالمللی در مورد SCP در سال 1967 در انستیتو تكنولوژی ماساچوست برگزار شد. در این زمان بیشتر پروژهها در مراحل آزمایشگاهی بود. در كنفرانس دوم كه در سال 1973 برگزار شد، بسیاری از كمپانیها در كشورهای مختلف تولید SCP را در مقیاس صنعتی شروع كرده بودند. تولید SCP از مخمر تورولا برای اولین بار در جنگ جهانی اول توسط آلمانها انجام شد. در اواسط سال 1930 و جنگ جهانی دوم، این امر مورد توجه بیشتری قرار گرفت و تولید آن به 15 هزار تن در سال رسید. در سال 1959 تیم تحقیقاتی شركت نفت بریتانیا مشاهده كرد كه میكروارگانیسم مورد مطالعة آنها قادر به رشد بر روی نرمال پارافین است و در سال 1965 واحدی برای تولید SCP به میزان 4000 تن در سال، طراحی و ساخته شد و در نهایت در سال 1976 كارخانهای با ظرفیت صد هزار تن در سال مورد بهرهبرداری قرار گرفت. در آن زمان، بهدلیل محتوای بالای اسیدهای هستهای SCP (كه بخاطر دستیابی به سرعت رشد بالاتر توسط میكروارگانیسمهای تكسلولی تولید میشود)، امكان استفاده از آن در خوراك انسان وجود نداشت. ...
متانول

ریشه لغوی واژه متیل الکل ریشه یونانی دارد. Methuبه معنی شراب و hyel به معنی چوب است. متیل در سال 1840 از کلمه متیلن مشتق شد و برای نامیدن متیل الکل استفاده شد. درسال 1892 از طرف انجمن بین المللی نامگذاری ترکیبات شیمیایی ، متیل الکل به متانول تغییر نام یافت. نگاه کلی متانول به نام متیل الکل و الکل چوب هم شناخته میشود. متانول یک ترکیب شیمیایی با فرمول CH3OH بوده و سادهترین نوع الکل است. متانول مایعی سبک ، فرار ، بدون رنگ و قابل اشتعال است. در اثر سوختن در هوا دیاکسید کربن و آب تولید میکند. متانول با شعلهای تقریبا بیرنگ میسوزد. این ترکیب از متابولیسم غیر هوازی گونههای زیادی از باکتریها تولید میشود. در نتیجه مقدار اندکی از بخار متانول در جو وجود دارد.متانول موجود در اتمسفر بعد از گذشت چند روز توسط اکسیژن و نور خورشید به CO2 اکسید میشود. تاریخچه در فرآیند مومیایی کردن در مصر باستان ، از مادهای استفاده میشد که حاوی متانول بود و از تجزیه حرارتی چوب بدست میآمد. متانول خالص اولین بار در سال 1661 توسط رابرت بویل از چوب استخراج شد. در سال 1834 شیمیدانهای فرانسوی انجمن Jean-Babtist ، ترکیب عناصر آن را بدست آوردند و همچنین کلمه متیلن را به شیمی آلی معرفی کردند.در سال 1923 شیمیدان آلمانی ، "ماتیاس" پیر ، متانول را از گاز سنتز (مخلوطی از CO و H2 که از کک بدست میآید) تولید کرد. در این فرآیند ، از کرومات روی به عنوان کاتالیزور استفاده میشد و واکنش در شرایط سختی مانند فشار 1000-300 اتمسفر و دمای حدود 400 درجه سانتیگراد انجام میگرفت. در شیوه مدرن تولید متانول ، از کاتالیزورهایی استفاده میشود که در فشارهای پائین عمل میکنند و کارایی موثرتری دارند. تولید امروزه گاز سنتز مورد نظر برای تولید متانول مانند گذشته از زغال بدست نمیآید، بلکه از واکنش متان موجود در گازهای طبیعی تحت فشار ملایم 10-20 اتمسفر و دمای 850 درجه سانتیگراد با بخار آب و در مجاورت کاتالیزور نیکل تولید میشود. CO و H2 تولید شده ، تحت تاثیر کاتالیزوری که مخلوطی از مس و اکسید روی و آلومینیوم است، واکنش داده و متانول ایجاد میکنند. این کاتالیزور اولین بار درسال 1966 توسط ICI استفاده شد. این واکنش در فشار 50-100 اتمسفر و دمای 250 درجه سانتیگراد صورت میگیرد.روش دیگر تولید متانول ، واکنش دیاکسیدکربن با هیدروژن اضافی است که تولید متانول و آب میکند. کاربرد متانول به صورت محدود به عنوان سوخت در موتورهایی با سیستم احتراق داخلی استفاده میشود. متانول تولید شده از چوب و سایر ترکیبات آلی را متانول آلی یا بیو الکل مینامند که یک منبع تجدید شدنی برای سوخت است و میتواند ...
روش نوین سنتز کاتالیست فرایند تولید دی متیل اتر
ذخایر بسیار غنی گاز طبیعی، به خصوص منطقه پارس جنوبی درخلیج فارس، یکی از بزرگترین منابع گازی جهان را در اختیار دارد. نزدیکی به بازارهای جهانی بویژه کشورهای جنوب آسیا و اروپا، ایرانرا به یکی از امنترین و اقتصادیترین کشورهای صاحب گاز طبیعی تبدیل کرده است که نقش انکارناپذیری در منطقه خاورمیانه دارد. فناوری تولید متانول از گاز سنتز، فرآیندی شناخته شده است که چندین دهه مورد مطالعه قرار گرفته است. لکن در فرایند سنتز متانول بهدلیل ماهیت برگشتپذیر واکنش تولید این ماده، دستیابی به حداکثر میزان تبدیل گاز سنتز در یک بار گذر از راکتور محدود است. تبدیل همزمان متانول به سایر مواد شیمیایی از قبیل اولفینها، دیمتیل اتر و... میتواند راه حل مناسبی برای کاهش محدودیت تعادلی واکنش سنتز متانول باشد. رضا خوشبین، دانشجوی دکتری مهندسی شیمی دانشگاه تربیت مدرس، در مورد هدف این تحقیقات توضیح داد: «دی متیل اتر یکی از مهمترین محصولات تبدیل شیمیایی گاز طبیعی است که تهیه آن به روش اقتصادی لازم و ضروری به نظر میرسد. لذا با توجه به ارزش افزوده بالای این محصول و نیز کاربردهای وسیع DME، این طرح با هدف بومیسازی دانش فنی تولید کاتالیستهای دو عاملی فرایند تبدیل مستقیم گاز سنتز به دی متیل اتر انجام شد.» در حال حاضر دی متیل اتر (DME) بهصورت تجاری از طریق واکنش آبگیری ازمتانول و با استفاده از کاتالیستهای اسیدی تولید میشود. در روش نوین، این ماده از گاز سنتز و در یک راکتور منفرد بر روی کاتالیستهای دو عاملی تولید میشود. فرایند تبدیل مستقیم گاز سنتز به DME (STD)، علاوهبر کاهش هزینههای تولید این ماده، موجب حذف محدودیتهای تعادلی ناشی از واکنش تولید متانول و در نتیجه افزایش میزان تولید این ماده نسبت به روش غیر مستقیم خواهد شد. لذا این طرح به منظور دستیابی به کاتالیست بهینه قابل استفاده در این فرایند تعریف و انجام شد. خوش بین در توضیحات تکمیلی نحوه انجام این تحقیقات افزود: «در این تحقیق، ابتدا با استفاده از نتایج حاصل از مطالعات کتابخانهای، در ساختار کاتالیست دو عاملی از ترکیب Cuo-ZnO-Al2O3 به عنوان عامل متانول ساز و زئولیت HZSM-5 به عنوان عامل آبگیری استفاده شد. در گام دوم عملکرد کاتالیستهای سنتز شده به روشهای متداول از قبیل تلقیح، رسوبی و اختلاط فیزیکی، با نتایج حاصل از بهکارگیری تکنیک امواج ماوراء صوت مقایسه شد. در ادامه، عوامل مؤثر در بهبود عملکرد کاتالیست سنتز شده به روش اولتراسوند از قبیل تأثیرتأثیر ترکیب کاتالیست و نسبت عامل متانول ساز ...
متانول
متانول ریشه لغوی واژه متیل الکل ریشه یونانی دارد. Methuبه معنی شراب و hyel به معنی چوب است. متیل در سال 1840 از کلمه متیلن مشتق شد و برای نامیدن متیل الکل استفاده شد. درسال 1892 از طرف انجمن بین المللی نامگذاری ترکیبات شیمیایی ، متیل الکل به متانول تغییر نام یافت. نگاه کلی متانول به نام متیل الکل و الکل چوب هم شناخته میشود. متانول یک ترکیب شیمیایی با فرمول CH3OH بوده و سادهترین نوع الکل است. متانول مایعی سبک ، فرار ، بدون رنگ و قابل اشتعال است. در اثر سوختن در هوا دیاکسید کربن و آب تولید میکند. متانول با شعلهای تقریبا بیرنگ میسوزد. این ترکیب از متابولیسم غیر هوازی گونههای زیادی از باکتریها تولید میشود. در نتیجه مقدار اندکی از بخار متانول در جو وجود دارد.متانول موجود در اتمسفر بعد از گذشت چند روز توسط اکسیژن و نور خورشید به CO2اکسید میشود. تاریخچه در فرآیند مومیایی کردن در مصر باستان ، از مادهای استفاده میشد که حاوی متانول بود و از تجزیه حرارتی چوب بدست میآمد. متانول خالص اولین بار در سال 1661 توسط رابرت بویل از چوب استخراج شد. در سال 1834 شیمیدانهای فرانسوی انجمن Jean-Babtist ، ترکیب عناصر آن را بدست آوردند و همچنین کلمه متیلن را به شیمی آلی معرفی کردند.در سال 1923 شیمیدان آلمانی ، "ماتیاس" پیر ، متانول را از گاز سنتز (مخلوطی از CO و H2 که از کک بدست میآید) تولید کرد. در این فرآیند ، از کرومات روی به عنوان کاتالیزور استفاده میشد و واکنش در شرایط سختی مانند فشار 1000-300 اتمسفر و دمای حدود 400 درجه سانتیگراد انجام میگرفت. در شیوه مدرن تولید متانول ، از کاتالیزورهایی استفاده میشود که در فشارهای پائین عمل میکنند و کارایی موثرتری دارند. تولید امروزه گاز سنتز مورد نظر برای تولید متانول مانند گذشته از زغال بدست نمیآید، بلکه از واکنش متان موجود در گازهای طبیعی تحت فشار ملایم 10-20 اتمسفر و دمای 850 درجه سانتیگراد با بخار آب و در مجاورت کاتالیزور نیکل تولید میشود. CO و H2 تولید شده ، تحت تاثیر کاتالیزوری که مخلوطی از مس و اکسید روی و آلومینیوم است، واکنش داده و متانول ایجاد میکنند. این کاتالیزور اولین بار درسال 1966 توسط ICI استفاده شد. این واکنش در فشار 50-100 اتمسفر و دمای 250 درجه سانتیگراد صورت میگیرد.روش دیگر تولید متانول ، واکنش دیاکسیدکربن با هیدروژن اضافی است که تولید متانول و آب میکند. کاربرد متانول به صورت محدود به عنوان سوخت در موتورهایی با سیستم احتراق داخلی استفاده میشود. متانول تولید شده از چوب و سایر ترکیبات آلی را متانول آلی یا بیو الکل مینامند که یک منبع تجدید شدنی برای سوخت است ...
فرایند پتروشیمی
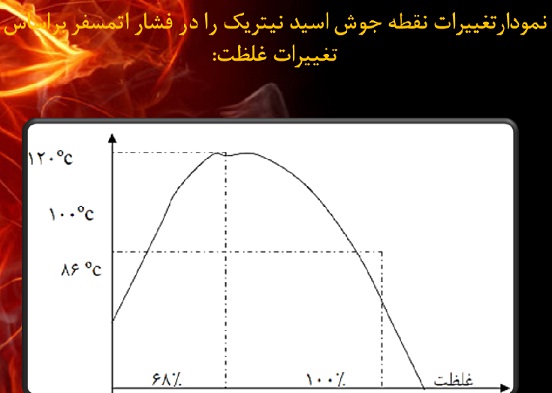
من اینو دیشب زدم نمی دونم چرا حذفش کردن؟( فرزاد که دیشب برامون بستنی خرید. عباس هم که مشکلی نداره با خندوندن مسلمین)فرزاد زنده بودی تو این 1دقیقه و 30ثانیه ارائش کی و کجا این اسلاید رو نشون دادو اصلا الان یکی بیاد دربارش توضیح بده ببینم چیه لطفا. والا با ای نوناشون... فرایند تولید آمونیاک(ارائه برتر) فرآیند تولید متانول فرآیند تولید الفین فرایند تولید اتیلن گلایکول متمم فایل ارایه برتر فرایند تولید نیتریک اسید متمم فایل نیتریک اسید ادامه فایل اتیلن گلایکول
انواعی از سوخت های طبیعی
بر اساس این گزارش، دانشمندان در فرآیند تولید این سوخت طبیعی از دو نوع باکتری برای تبدیل ترکیب نور خورشید و دی اکسید کربن و تولید نوعی هیدروکربن استفاده کردند. این هیدورکربن نیز پس از انجام یک سری فعل و انفعالات میتواند به سوخت تبدیل شود که از سوی دانشمندان فرآیند «تولید فنا ناپذیر» نامگذاری شده است. مواردی از این چشم انداز:1- دانشمندان با استفاده از باکتریها موفق به تولید سوخت از دی اکسیدکربن و نورخورشید شدند. این فرآیند در ابتدا با کمک باکتریای به نام « Synechococcus» آغاز میشود که دی اکسید کربن را با استفاده از انرژی نور خورشید تبدیل به نوعی شکر میکند. این شکر نیز با کمک باکتری دیگری به نام « Shewanella» بدل به سوخت میشود. این باکتری، شکر تولیدی را مصرف و نوعی اسید چرب تولید میکند. در ادامه این فرآیند، این اسید چرب بدل به کتون میشود که سوخت ارگانیک به شمار میرود. در نهایت، این کتون با انجام دادن یک سری فعل و انفعالات شیمیایی تبدیل به گازوئیل می شود. این کشف از آنجایی دارای اهمیت بسیار است که در اتمسفر کره زمین دی اکسیدکربن به وفور یافت می شود و البته رایگان است و اگر این کشف به مرحله تولید انبوه برسد، می تواند به مقدار بسیار زیادی به کاهش آلودگیهای زیست محیطی کمک کند. گفتنی است، این کشف مربوط به تز دکترای خانم جانیکا فریس، دانشجوی رشته بیوشیمی است. 2جلبک های ریز(Microalgae) و تولید سوخت: برای تولید سوخت از جلبک ویژگی هایی باید مورد توجه قرار گیرند ، که شامل دارا بودن میزان زیاد چربی ، توانایی رشد در بیشتر مکان ها و داشتن رشد سریع است. بیودیزل می تواند طی واکنش هر منبع روغنی و چربی با الکل تولید شود. برای تولید بیودیزل تری گلسیرید ها با متانول طی واکنش ترانس استریفیکاسیون واکنش داده که طی آن اسید چرب یا متیل استر تولید می شود. منابع بازی قوی مثل هیدروکسید سدیم (NaOH) و هیدروکسید پتاسیم (KOH) بطور معمول بعنوان کاتالیست برای افزایش میزان تولید بیودیزل استفاده می شوند. طی تولید بیودیزل در ابتدا سه مولکول اسید چرب با یک مولکول گلیسرول استریفیه شده و تولید تری گلیسرول می کند. طی واکنش ترانس استریفیکاسیون به ازای هر مولکول تری گلیسیرید نیاز به 3 مول الکل است. لیپاز نیز می تواند بعنوان کاتالیست برای تولید بیشتر استفاده شود ، که هزینه بالای آن انجام این امر را کم می کند. کاتالیز توسط قلیا در دمایی حدود 60 درجه و تحت فشار اتمسفر انجام می شود ، و زمان لازم برای انجام واکنش 60 دقیقه است. در پایان واکنش ها بیودیزل توسط شستشوی مکرر بوسیله آب و دفع متانول و گلیسرول بازیافت می شوند 3محققان سوئدی در راستای برنامه ...
اتانول
تاریخچه اتانول برای انسان از دوران باستان شناخته شده بود، زیرا این ماده ، جزء اصلی مشروبات الکلی است. جداسازی آن بصورت اتانول نسبتا خالص احتمالا اولین بار توسط "جابر بن حیان" که صنعت تقطیر را گسترش داد، انجام شده است. البته بیشتر گمان میرود که اتانول خالص توسط "محمد زکریای رازی" دانشمند ایرانی تولید شده باشد. فرایند تولید اتانول مورد استفاده در نوشابههای الکلی توسط فرایند تخمیر از متابولیسم گلوکز توسط گونه مخصوصی از مخمرها در غیاب اکسیژن تولید میشود و در پایان فرایند تخمیر غلظت اتانول را با تقطیر بالا میبرند. برای مخلوط اتانول با آب بالاترین نقطه آزئوتروپ جوش برای 95% الکل و 5% آب است. بنابراین جزء تقطیر شده مخلوط اتانول و آب نمیتواند خالصتر از 95 درصد باشد. برای تولید اتانول خالصتر ، مقدار کمی بنزن به آن اضافه میشود.بنزن ، آزئوتروپ سهگانه ای با آب و اتانول تشکیل میدهد و مخلوط دوباره تقطیر میشود. نتیجه این فرایند بدست آوردن اتانول بدون آب است. با این همه چند ppm بنزن در اتانول باقی میماند که جذب آن در بدن از مشخصههای آسیب کبدی است که در افراد الکلی دیده میشود. تولید اتانول صنعتی اتانول سوخت نسبتا خوبی برای موتورهاست و در صنعت ، بصورتهای مختلفی استفاده میشود. اتانول مورد مصرف در صنعت را معمولا از واکنش کاتالیزوری آب با اتیلن تولید میکنند. این یک واکنش افزایشی است که در آن یک مولکول آب شکافته شده ، قطعات حاصل از آن به اتمهای کربن در پیوند دوگانه اضافه میشود. این فرایند ، تولید اتانول اقتصادیتر از تولید آن با مخمر است.امروزه برای تولید تجارتی آسان آن تخمیر مواد آلی زائد مانند خرده چوب و خاک اره پیشنهاد شده است. اتانول صنعتی برای مصرف انسان ، نامناسب است، زیرا به آن ، مقادیر کمی متانول و مواد سمی دیگر اضافه میشود. خواص فیزیکی اتانول ، مایعی قابل احتراق و بیرنگ بوده ، یکی از انواع الکلهای موجود در نوشابههای الکلی است. گرانروی آن ، مانند آب است و بوی نسبتا تندی دارد. در صنعت بعنوان حلال و ماده واسطه شیمیایی برای تولید بیشتر ترکیبات آلی استفاده میشود. بدلیل تشکیل پیوند هیدروژنی با هر نسبتی در آب حل میشود. اتانول در مقایسه با ترکیبات آلی که وزن مولکولی یکسانی با آن دارند، نقطه جوش بالاتری دارد.به عنوان مثال نقطه جوش پروپان که تقریبا وزن مولکولی برابری با اتانول دارد، 43- درجه سانتیگراد است، درحالیکه نقطه جوش اتانول 78 درجه سانتیگراد است. دلیل این اختلاف ، وجود پیوندهای هیدروژنی مربوط به گروه OH است که نیروی جاذبه میان مولکولهای مجاور را افزایش میدهد. اتانول ...
تبدیل متانول به فرمالدهید ، الفین ها و متیل ترشیری بوتیل اتر ( MTBE )
1- مقدمه : استفادة بهينه از گاز طبيعي در جهان به معني پيشرفت تكنولوژي استحصال اين حامل انرژي، توسعة فناوريهاي انتقال و تبديل آن و در نتيجه افزايش روزافزون توليد و تجارت آن است. به طور كلي جهت استفاده از گاز طبيعي دو راهكار عمده وجود دارد : 1 - پالايش گاز طبيعي و استفاده از آن به عنوان سوخت و واردشدن در بازار تجارت گاز طبيعي 2 - استفاده از گاز طبيعي ضمن تبديل آن به فراوردههاي باارزش گازسنتز چيست؟ اصطلاح گاز سنتز به مخلوطهاي گازي اطلاق ميشود كه محتوي منوكسيدكربن و هيدروژن به نسبتهاي مختلف باشند. هيدروژن و منوكسيدكربن دو مادة مهم در صنايع شيميايي محسوب شده و داراي مصارف و كاربردهاي فراواني ميباشند. منوكسيدكربن در توليد رنگها، پلاستيكها، فومها، حشرهكشها، علفكشها، اسيدها و ... به كار ميرود. از جمله مصارف هيدروژن نيز ميتوان به توليد آمونياك، هيدروژناسيون و هيدروكراكينگ اشاره نمود. گاز سنتز مادة اوليه بسيار با ارزشي جهت توليد مواد متنوع شيميايي ميباشد. با استفاده از اين گاز و فرايندهاي مختلف، ميتوان مواد متنوع شيميايي را توليد نمود كه بسته به روش توليد آن نسبتهاي مختلف هيدروژن به منوكسيدكربن به دست ميآيد. همچنين در موارد مصرف در صنعت، بسته به فرايندي كه گاز در آن مورد استفاده قرار ميگيرد، نسبتهاي مختلف لازم است. موارد مصرف گاز سنتز عمده موارد مصرف گاز سنتز عبارتند از : 1- تهیه متانول 2- تهیه اتیلن گلیکول 3 - واكنشهاي هيدروفرميلدار كردن 4 - سنتز فيشر- تروپش 5 - احياي سنگ آهن 6 - ساير مصارف از جمله ديگر مصارف گاز سنتز، ميتوان به تهيه الكلهاي سنگين، ديمتيل اتر، استرها، كتونها، هيدروكربورها و غيره اشاره كرد. متانول متانول یا متیل الکل یا الکل متیلیک یا الکل چوب که سادهترین نوع الکلهاست با فرمول شیمیایی CH₃OH شناخته میشود. متانول از فعالیت بیهوازی گونههای زیادی از باکتریها تولید میشود و در نتیجه مقدار اندکی از بخار متانول وارد جو میشود و پس از چندین روز بهوسیله اکسیژن و با کمک نور خورشید اکسید شده به آب و دی اکسید کربن تبدیل میگردد. البته در فرآیند سوختن متانول هم از نظر مواد بدست آمده چنین اتفاقی رخ میدهد ولی بسیار سریعتر. در ضمن شعله سوختن متانول بیرنگ است و باید مراقب باشیم تا با شعله آن دچار سوختگی نشویم. O₂H4+ ₂CO2 ⟶ ₂O3+ OH ₃CH2 در سال 1923 شیمیدان آلمانی ، "ماتیاس" پیر ، متانول را از گاز سنتز ( مخلوطی از CO و H2 که از کک بدست میآید) تولید کرد. در این فرآیند ، از کرومات روی به عنوان کاتالیزور ...
